ข้อสอบ PAT
วันอาทิตย์ที่ 8 กันยายน พ.ศ. 2562
การใช้ประโยชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
จากการที่สารประกอบไอออนิกสารโคเวเลนต์และโลหะมีสมบัติเฉพาะตัวมาว่าการที่ต่างกันจึงสามารถนำมาใช้ประโยชน์ในด้านต่างๆได้ตามความเหมาะสม เช่น
- แอมโมเนียมคลอไรด์และซิงค์คลอไรด์ เป็นสารประกอบไอออนิกที่สามารถนำไฟฟ้าได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ำจึงนำไปใช้เป็นสารอิเล็กโทรไลต์ในถ่านไฟฉาย
- พอลิไวนิลคลอไรด์หรือ PVC เป็นสารโคเวเลนต์ที่ไม่สามารถนำไฟฟ้าได้จึงเป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า
- ซิลิกอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่างตาข่ายที่มีจุดหลอมเหลวสูงและมีความแข็งแรงมากจึงนำไปใช้ทำเครื่องบด
- ทองแดงและอะลูมิเนียม เป็นโลหะที่นําไฟฟ้าได้ดีจึงนำไปใช้เป็นตัวนำไฟฟ้าอลูมิเนียมและเหล็กเป็นโลหะที่นําความร้อนได้ดีจึงนำไปทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กระทะ
วันเสาร์ที่ 7 กันยายน พ.ศ. 2562
พันธะโลหะ
การเกิดพันธะโลหะ
การที่อะตอมโลหะมีค่าพลังงานไอออไนเซชันต่ำ การยึดเหนี่ยวระหว่างเวเลนซ์อิเล็กตรอนกับโปรตอนในนิวเคลียสจึงน้อย ทำให้เวเลนซ์อิเล็กตรอนสามารถเคลื่อนที่ได้อย่างอิสระไปทั่วทั้งชิ้นโลหะและเกิดการยึดเหนี่ยวกับโปรตอนในนิวเคลียสทุกทิศทาง เรียกว่า พันธะโลหะ แสดงได้ด้วยแบบจำลองทะเลอิเล็กตรอน
สมบัติของโลหะ
พันธะโลหะ (Metallic Bond) คือ แรงดึงดูดระหว่างไอออนบวกซึ่งเรียงชิดกันกับอิเล็กตรอนที่อยู่โดยรอบหรือเป็นแรงยึดเหนี่ยวที่เกิดจากอะตอมในก้อนโลหะใช้เวเลนซ์อิเล็กตรอนทั้งหมดร่วมกัน
การเกิดพันธะโลหะ
การที่อะตอมโลหะมีค่าพลังงานไอออไนเซชันต่ำ การยึดเหนี่ยวระหว่างเวเลนซ์อิเล็กตรอนกับโปรตอนในนิวเคลียสจึงน้อย ทำให้เวเลนซ์อิเล็กตรอนสามารถเคลื่อนที่ได้อย่างอิสระไปทั่วทั้งชิ้นโลหะและเกิดการยึดเหนี่ยวกับโปรตอนในนิวเคลียสทุกทิศทาง เรียกว่า พันธะโลหะ แสดงได้ด้วยแบบจำลองทะเลอิเล็กตรอน
สมบัติของโลหะ
พันธะโลหะ (Metallic Bond) คือ แรงดึงดูดระหว่างไอออนบวกซึ่งเรียงชิดกันกับอิเล็กตรอนที่อยู่โดยรอบหรือเป็นแรงยึดเหนี่ยวที่เกิดจากอะตอมในก้อนโลหะใช้เวเลนซ์อิเล็กตรอนทั้งหมดร่วมกัน
พันธะโลหะจะมีความสำคัญต่อคุณสมบัติทางฟิสิกส์หลายอย่างของโลหะเช่น
- ความแข็งแรง
- ตีแผ่เป็นแผ่นได้
- ดึงเป็นเส้นได้
- นำความร้อนไดดี
- นำไฟฟ้าได้ดีและนำได้ทุกทิศทาง
- เนื้อเป็นเงา
พันธะโคเวเลนต์
การเกิดพันธะโคเวเลนต์
พันธะเคมีที่เกิดขึ้นระหว่างอะตอมของธาตุอโลหะกับธาตุโลหะที่เข้ามาสร้างแรงยึดเหนี่ยวต่อกัน เนื่องจากธาตุอโลหะจะมีสมบัติเป็นตัวรับอิเล็กตรอนที่ดีและยากต่อการสูญเสียอิเล็กตรอน ดังนั้นอิเล็กตรอนของธาตุทั้งสองจึงต่างส่งแรงดึงดูดเพื่อที่จะดึงดูดอิเล็กตรอนของอีกฝ่ายให้เข้าหาตนเอง ทำให้แรงดึงดูดจากนิวเคลียสของอะตอมทั้งสองหักล้างกัน
ตารางเเสดงความยาวพันธะ
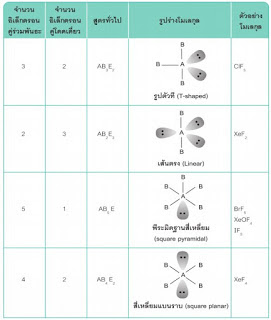
รูปร่างโมเลกุลโคเวเลนต์
สภาพของขั้วของโมเลกุล
ถ้ามีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอตอมทั้งสองเท่ากัน เรียกว่า พันธะโคเวเลนต์ไม่มีขั้ว ส่วนสารโคดวดลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีต่างกันจะมีการกระจายตัวของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมไม่เท่ากัน เรียกว่า พันธะโคเวเลนต์มีขั้ว
การเกิดพันธะโคเวเลนต์
พันธะเคมีที่เกิดขึ้นระหว่างอะตอมของธาตุอโลหะกับธาตุโลหะที่เข้ามาสร้างแรงยึดเหนี่ยวต่อกัน เนื่องจากธาตุอโลหะจะมีสมบัติเป็นตัวรับอิเล็กตรอนที่ดีและยากต่อการสูญเสียอิเล็กตรอน ดังนั้นอิเล็กตรอนของธาตุทั้งสองจึงต่างส่งแรงดึงดูดเพื่อที่จะดึงดูดอิเล็กตรอนของอีกฝ่ายให้เข้าหาตนเอง ทำให้แรงดึงดูดจากนิวเคลียสของอะตอมทั้งสองหักล้างกัน
พันธะเดี่ยว (single bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกันมีการใช้ร่วมสร้างพันธะต่อกันมีการใช้อิเล็กตรอนร่วมกัน 1 คู่
พันธะคู่ (double bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกันมีการใช้อิเล็กตรอนร่วมกัน 2 คู่
พันธะสาม (triple bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกัน มีการใช้อิเล็กตรอนร่วมกัน 3 คู่
สูตรโมเลกุลและชื่อของสารโคเวเลนต์
การอ่านชื่อสารโคเวเลนต์ มีวิธีการอ่านดังนี้
- อ่านจำนวนอะตอมพร้อมชื่อธาตุแรก (ในกรณีธาตุแรกมีอะตอมเดียวไม่ต้องอ่านจำนวน )
- อ่านจำนวนอะตอม และชื่อธาตุที่สอง ลงท้ายเป็น ไ-ด์ (ide )
เลขจำนวนอะตอมอ่านเป็นภาษากรีก คือ
1 = mono 2 = di
3 = tri 4 = tetra
5 = penta 6 = hexa
7 = hepta 8 = octa
9 = nona 10 = deca
ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
ตารางเเสดงพลังงาน
ถ้ามีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอตอมทั้งสองเท่ากัน เรียกว่า พันธะโคเวเลนต์ไม่มีขั้ว ส่วนสารโคดวดลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีต่างกันจะมีการกระจายตัวของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมไม่เท่ากัน เรียกว่า พันธะโคเวเลนต์มีขั้ว
แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
แรงลอนดอน เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล ยึดเหนี่ยวกันด้วยแรงอ่อนๆ ซึ่งเกิดขึ้นในสารทั่วไป และจะมีค่าเพิ่มขึ้นตามมวลโมเลกุลของสาร
แรงดึงดูดระหว่างขั้ว เป็นแรงดึงดูดทางไฟฟ้าอันเนื่องมาจากแรงกระทำระหว่างขั้วบวกกับขั้วลบของโมเลกุลที่มีขั้ว
พันธะไฮโดรเจน คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจน
ซึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็นพันธะไฮโดรเจน
สารโคเวเลนต์โครงร่างตาข่าย
สารโคเวเลนต์ที่ศึกษามาแล้วมีโครงสร้างโมเลกุลขนาดเล็ก มีจุดหลอมเหลวและจุดเดือดต่ำ แต่มีสารโคเวเลนต์บางชนิดมีโครงสร้างโมเลกุลขนาดยักษ์ มีจุดหลอมเหลวและจุดเดือดสูงมาก เนื่องจากอะตอมสร้างพันธะโคเวเลนต์ยึดเหนี่ยวกันทั้งสามมิติเกิดเป็นโครงสร้างคล้ายตาข่ายสารประเภทนี้เรียกว่าสารโครงผลึกร่างตาข่ายตัวอย่างสารโครงผลึกร่างตาข่าย
ซึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็นพันธะไฮโดรเจน
สารโคเวเลนต์โครงร่างตาข่าย
สารโคเวเลนต์ที่ศึกษามาแล้วมีโครงสร้างโมเลกุลขนาดเล็ก มีจุดหลอมเหลวและจุดเดือดต่ำ แต่มีสารโคเวเลนต์บางชนิดมีโครงสร้างโมเลกุลขนาดยักษ์ มีจุดหลอมเหลวและจุดเดือดสูงมาก เนื่องจากอะตอมสร้างพันธะโคเวเลนต์ยึดเหนี่ยวกันทั้งสามมิติเกิดเป็นโครงสร้างคล้ายตาข่ายสารประเภทนี้เรียกว่าสารโครงผลึกร่างตาข่ายตัวอย่างสารโครงผลึกร่างตาข่าย
พันธะไอออนิก
การเกิดพันธะไอออนิก
พันธะไอออนิก เป็นพันธะเคมีชนิดหนึ่ง เกิดจากที่อะตอมหรือกลุ่มของอะตอมสร้างพันธะกันโดยที่อะตอมหรือกลุ่มของอะตอมให้อิเล็กตรอนกับอะตอมหรือกลุ่มของอะตอม ทำให้กลายเป็นประจุบวก ในขณะที่อะตอมหรือกลุ่มของอะตอมที่ได้รับอิเล็กตรอนนั้นกลายเป็นประจุลบ เนื่องจากทั้งสองกลุ่มมีประจุตรงกันข้ามกันจะดึงดูดกัน ทำให้เกิดพันธะไอออน โดยทั่วไปพันธะชนิดนี้มักเกิดขึ้นระหว่างโลหะกับอโลหะ
การเกิดพันธะไอออนิก
พันธะไอออนิก เป็นพันธะเคมีชนิดหนึ่ง เกิดจากที่อะตอมหรือกลุ่มของอะตอมสร้างพันธะกันโดยที่อะตอมหรือกลุ่มของอะตอมให้อิเล็กตรอนกับอะตอมหรือกลุ่มของอะตอม ทำให้กลายเป็นประจุบวก ในขณะที่อะตอมหรือกลุ่มของอะตอมที่ได้รับอิเล็กตรอนนั้นกลายเป็นประจุลบ เนื่องจากทั้งสองกลุ่มมีประจุตรงกันข้ามกันจะดึงดูดกัน ทำให้เกิดพันธะไอออน โดยทั่วไปพันธะชนิดนี้มักเกิดขึ้นระหว่างโลหะกับอโลหะ
สูตรเคมีและชื่อของสารประกอบไอออนิก
พลังงานกับการเกิดสารประกอบไอออนิก
พลังงานที่เกี่ยวข้องกับการรวมกันของไอออนบวกและลบในสารประกอบไอออนิกเรียกว่า พลังงานโครงผลึก สามารถหาค่าพลังงานได้ด้วยการคำนวณ โดยอาศัยวัฏจักรบอร์น-ฮาเบอร์ ประกอบด้วยขั้นตอนต่างๆดังนี้
1.ของแข็งระเหิดกลายเป็นแก๊ส เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานการระเหิด
2.พลังงานที่ใช้ในการเสียอิเล็กตรอนให้กลายเป็นไอออนบวกเป็นไอออนลบ เรียกว่า พลังงานไอออไนเซชัน
3.พลังงานที่ใช้ในการสลายโมเลกุลของแก๊สให้เป็นอะตอมในสถานะแก๊ส เรียก พลังงานการสลายพันธะ
4.พลังงานที่คายออกมาเมื่อมีการรับอิเล็กตรอนให้กลายเป็นประจุลบเรียกว่า พลังงานสัมพรรรคภาพอิเล็กตรอน5.
พลังงานที่ได้ออกมาเมื่อมีการยึดไอออนบวกกับไอออนลบให้กลายเป็นของแข็ง เรียกว่า พลังงานโครงผลึกหรือพลังงานแลตทิซ
สมบัติของสารประกอบไอออนิก
1.มีขั้ว สารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมากซึ่งยึดเหนี่ยวกัน ด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2.นำไฟฟ้าได้ เมื่อใส่สารประกอบไอออนนิกลงในน้ำ ไอออนจะแยกออกจากัน ทำให้สารละลายนำไฟฟ้าได้
3.มีจุดหลอมเหลวและจุดเดือดสูง เพราะต้องการพลังงานความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลว
4.การละลาย สารประกอบไอออนิกจะละลายในน้ำแต่ไม่ละลายในเบนซีนหรือตัวทำละลายอินทรีย์ น้ำและตัวทำละลายชนิดมีขั้ว
5.สารประกอบไอออนิกทำให้เกิดปฏิกริยาไอออนิก คือ ปฏิกริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฎิกริยาจึงเกิดทันที
6.เป้นผลึกเเข็งเเต่เปราะง่าย
สมการไอออนิกเเละสมการไอออนิกสุทธิ
สมการไอออนิกสุทธิ (net ionic equation) จะเป็นสมการที่เขียนเฉพาะไอออนที่ทำปฏิกิริยากันได้เป็นผลิตภัณฑ์เท่านั้น โดยผลรวมประจุทางซ้ายและทางขวาของสมการต้องดุลกันพอดี เช่น
การผสมสารละลายซิลเวอร์ไนเตรต (AgNO3) และโซเดียมคลอไรด์ (NaCl) ได้ตะกอนสีขาวของซิลเวอร์คลอไรด์ (AgCl) ซึ่งไม่ละลายน้ำ
สามารถเขียนสมการทั่วไป สมการไอออนิกและสมการไอออนิกสุทธิได้
การทำนายปฏิกิริยาการเกิดตะกอนของสารละลายของสารประกอบไอออนิก สามารถพิจารณาได้จากสมบัติการละลายน้ำ ดังนี้
สารประกอบที่ละลายน้ำ
- สารประกอบของโลหะแอลคาไลน์และแอมโมเนียมทุกชนิด
- สารประกอบไนเทรต คลอเรต เปอร์คลอเรต แอซีเตต
- สารประกอบคลอไรด์ โบรไมด์ ไอโอไดด์ ยกเว้นสารประกอบของ Ag+ Pb2+ Hg2+ ไม่ละลาย ส่วน PbCl2 ละลายได้น้อย
- สารประกอบซัลเฟต (ยกเว้นสารประกอบของ Pb2+ Sr2+ Ba2+ ส่วนสารประกอบของ Ca2+ และ Ag+ ละลายได้น้อย)
สารประกอบที่ไม่ละลายน้ำ
- สารประกอบของออกไซด์ของโลหะ (ยกเว้นออกไซด์ของ Ca2+ Sr2+ Ba2+)
- สารประกอบไฮดรอกไซด์ (ยกเว้นไฮดรอกไซด์ของโลหะแอลคาไล แอมโมเนียมและของ Sr2+ Ba2+ ส่วนของCa2+ ละลายได้น้อย)
- สารประกอบคาร์บอเนต ฟอสเฟต ซัลไฟด์และซัลไฟต์ (ยกเว้นสารประกอบของโลหะแอลคาไล)
สัญลักษณ์แบบจุดของลิวอิสและกฎออกเตต
สูตรโครงสร้างของลิวอิส
เป็นสูตรโครงสร้างที่กิลเบิร์ต ลิวอิสได้คิดค้นขึ้นมาเพื่อใช้ในการอธิบายรูปร่างโมเลกุล ซึ่งจะแบ่งได้เป็น 2 ประเภทได้แก่
-สูตรโครงสร้างส่วนที่เป็นจุด เป็นสูตรโครงสร้างที่ใช้จุดแทนอิเล็กตรอนวงนอกสุดของอะตอมที่เกิดพันธะ โดยให้อิเล็กตรอนครบตามกฎออกเตต ยกเว้นบางธาตุซึ่งมีการยกเว้นได้
-สูตรโครงสร้างส่วนที่เป็นเส้น เป็นสูตรโครงสร้างที่ใช้เส้นและจุดแทนอิเล็กตรอนวงนอกสุดของอะตอมที่เกิดพันธะ ซึ่งเส้น 1 เส้นจะแทนอิเล็กตรอน 2 ตัวหรือ 1 คู่ สามารถเขียนอิเล็กตรอนเดี่ยวด้วยก็ได้
กฎออกเตต
ธาตุก๊าซเฉื่อย เช่น He Ne Ar Kr พบว่าเป็นธาตุที่โมเลกุลเป็นอะตอมเดี่ยว คือในหนึ่งโมเลกุลของก๊าซเฉื่อยจะมีเพียง 1 อะตอม แสดงว่าเป็นธาตุที่เสถียรมาก ทำให้นักวิทยาศาสตร์สนใจที่จะค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร และจากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือมี 8 อิเล็กตรอน(ยกเว้น He มี 2 อิเล็กตรอน) เช่น
2He = 2 10Ne = 2 , 8 18Ar = 2 , 8 , 8 36Kr = 2 , 8 , 18 , 8
ส่วนธาตุหมู่อื่นมีการจัดเรียงอิเล็กตรอนในระดับพลังงานชั้นนอกสุด ไม่ครบ 8 เช่น
ธาตุที่มีวาเลนต์อิเล็กตรอนไม่ครบ 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยวๆได้ ซึ่งแสดงว่าไม่เสถียร การรวมกันเพื่อทำให้อะตอม มีวาเลนต์อิเล็กตรอนครบ 81H = 1 6C = 2 , 4 7N = 2 , 5 8O = 2 , 6
สมัครสมาชิก:
ความคิดเห็น (Atom)